检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
CD8+ T细胞的耗竭是抗肿瘤免疫的关键阻碍,当前研究集中于肿瘤微环境对CD8+ T细胞的调控,而忽视了CD8+ T细胞自身因素。不同肿瘤的微环境存在巨大差异, CD8+ T细胞无一例外进入耗竭状态,这暗示除了外在环境因素,尚可能存在驱动CD8+ T细胞耗竭的内在因素。因此,筛选在不同类型的肿瘤中普遍存在的CD8+ T细胞耗竭机制及潜在的驱动因素,可为同时靶向治疗不同肿瘤提供可能。
北京时间1月13日,张泽民课题组、李程课题组与清华大学江鹏课题组, 武汉科技大学祝海川课题组合作,在《自然-癌症》(Nature Cancer)期刊以长文的形式发表了题为“ETV7通过促进CD8+ T细胞命运向耗竭的转化,限制CD8+T细胞抗病毒和抗肿瘤的功能”(ETV7 limits the antiviral and anti-tumor efficacy of CD8+ T cells by diverting their fate towards exhaustion)的研究论文。作者从21种肿瘤病人中筛选到小鼠中缺失而人具有的转录因子ETV7,是驱动CD8+ T细胞命运向耗竭转化的核心,且广泛存在不同肿瘤中。临床前免疫治疗研究发现,靶向ETV7显著增强CAR-T细胞的抗实体瘤的治疗效果。
为了筛选在临床病人中广泛存在的免疫逃逸的关键因素,作者使用21种肿瘤病人的单细胞转录组数据与ATAC-seq数据进行多组学分析,并通过功能性筛选,鉴定到ETV7为全新促进CD8+T细胞终末分化的转录因子。进一步功能研究发现,ETV7的表达通过促进CD8+T细胞的耗竭,抑制其杀伤肿瘤和清除病毒的能力。
机制研究发现,在CD8+ T细胞分化过程中,ETV7作为中心调控因子,逐渐增强与耗竭基因(CTLA4、TOX等七个基因)和记忆基因(TCF7等4个基因)的结合与转录调控,通过结合和调控多个经典T细胞耗竭相关基因(CTLA4、TOX等七个基因)和记忆基因(TCF7等4个基因),将CD8+T细胞的命运从记忆转化为终末耗竭,说明ETV7可能是人CD8+ T细胞耗竭命运决定的中心调控因子(master regulator)。进一步将该研究应用于临床前实验中发现,在CAR-T治疗实体瘤模型中,敲低ETV7的表达能够显著抑制CAR-T细胞耗竭,增强CAR-T杀伤肿瘤的功能,为肿瘤免疫治疗提供了新的策略和筛选靶标。
清华大学江鹏团队博士后程洁(现为华中科技大学同济医学院独立PI)、清华大学2021级研究生肖一峰、威人斯尼平台注册彭婷博士、武汉科技大学张子健博士和华中科技大学秦铀副教授为本文的共同第一作者。清华大学江鹏副教授为本文通讯作者,武汉科技大学祝海川副教授、威人斯尼平台注册张泽民教授以及李程教授为本文的共同通讯作者。研究得到国家自然科学基金、清华-北大生命科学联合中心和博士后科学基金的经费支持,以及清华大学动物中心和流式分选平台的大力支持。
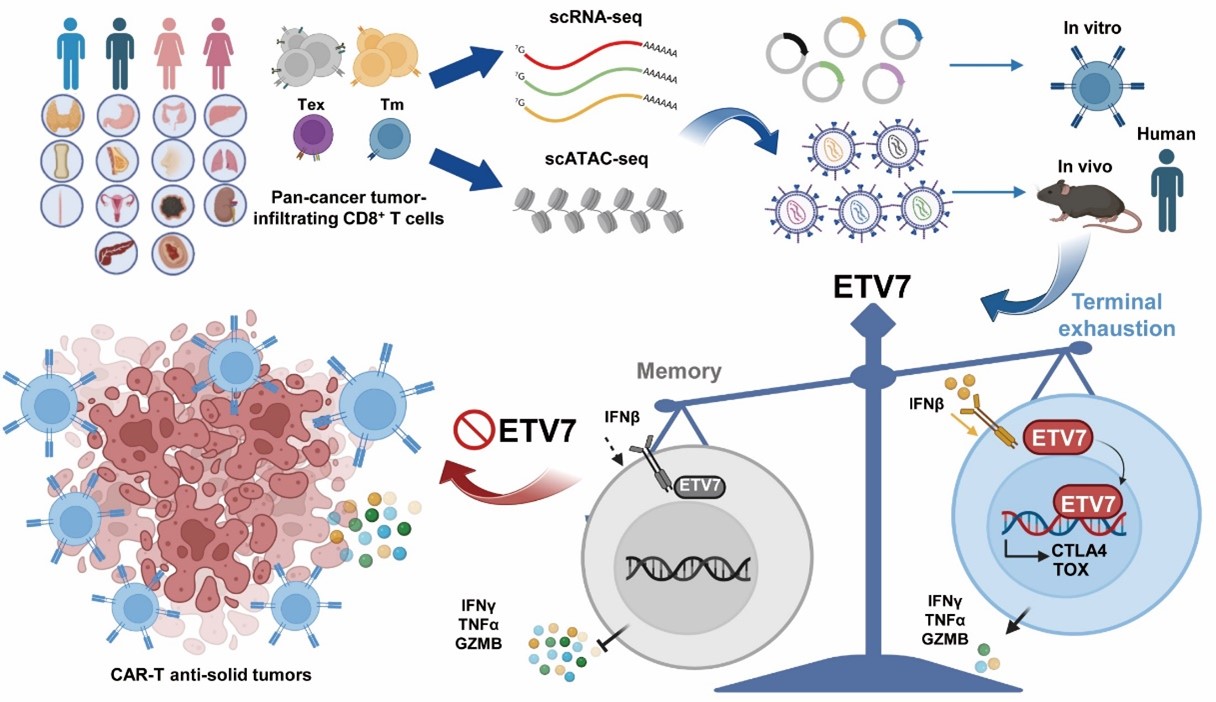
图1. 肿瘤病人单细胞多组学与筛选鉴定到ETV7作为调控CD8+T细胞命运的转录焦点,促进CD8+T细胞的终末分化(耗竭)与功能缺失。靶向ETV7有效增强CAR-T杀伤实体瘤的效率。